| Γλώσσα : |
|
| Εγκυκλοπαίδεια της κοινότητας |Εγκυκλοπαίδεια Απαντήσεις |Υποβολή ερωτήματος |Λεξιλόγιο Γνώση |Ανεβάστε τη γνώση |
Χημική Κινητική |
  |
|
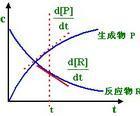
Χημική Κινητική (χημική κινητική) είναι η μελέτη του ρυθμού των διαδικασιών χημικής αντίδρασης και τη φυσική και χημική υποκατάστημα μηχανισμός της αντίδρασης, η οποία είναι οι ιδιότητες του υλικού των αλλαγών αντικειμένου με το χρόνο του συστήματος μη ισορροπίας δυναμικής.Σύντομη εισαγωγή Χημική κινητική, επίσης γνωστή ως κινητική της αντίδρασης, κινητική χημική αντίδραση, είναι ένας κλάδος της φυσικής χημείας, είναι η μελέτη των συντελεστών των χημικών διεργασιών και αντιδράσεων Φυσικές και χημικές κλαδιά μηχανισμούς. Είναι η μελέτη της φύσης της αλλαγής με τον χρόνο του συστήματος μη ισορροπίας δυναμικής. Κύριοι τομείς της έρευνας του περιλαμβάνουν: μοριακή δυναμική αντίδραση, κινητική, χημική κινητική αντίδραση, μακροσκοπικές δυναμική, μικρο δυναμική, κ.λπ., είναι επίσης κατατάσσονται ανάλογα με διάφορους κλάδους των οργανικών κινητικής χημικής αντίδρασης και ανόργανα κινητική αντίδραση. Χημική κινητική χημικές διεργασίες παραγωγής είναι συχνά ο αποφασιστικός παράγοντας. Ο χρόνος είναι μια σημαντική μεταβλητή στην χημική κινητική. Κινητική πειράματα κλασική μέθοδος δεν μπορεί να παρασκευαστούν σε ένα ενιαίο κβαντική κατάσταση των αντιδραστηρίων, δεν μπορεί να ανιχνευθεί από έναν μόνο αντίδραση που παράγεται από την σύγκρουση του εν τω γεννάσθαι προϊόντος. Θερμοδυναμικών ιδιοτήτων ισορροπίας της χημικής κινητικής μπορούν να λαμβάνουν τις πληροφορίες, μια ολοκληρωμένη κατανόηση της διαδικασίας χημικής αντίδρασης και να τεθεί σε εφαρμογή, δεν μπορεί να κάνει χωρίς χημική κινητική. Quantum χημικούς υπολογισμούς, ακόμα δεν μπορεί να πάρει το σύστημα αντίδρασης, και να ολοκληρώσει επιφανειακό δυναμικό ενέργειας. Ως εκ τούτου, η τρέχουσα θεωρία ταχύτητα αντίδρασης έπρεπε ακόμα να δανειστεί κλασική στατιστική προσέγγιση μηχανικής. Η επεξεργασία αυτή πρέπει να είναι κάποια μορφή παραδοχή ισοζυγίου, καθιστώντας έτσι αυτά τα θεωρητικά ποσοστά δεν μπορεί να χρησιμοποιηθεί για την πολύ γρήγορη ανταπόκριση. Παρά το γεγονός ότι η δυνατότητα εφαρμογής των υποθέσεων για τις μελέτες ισορροπίας έχουν γίνει πολλές, αλλά η πλήρης θεωρητική επεξεργασία των μη-ισορροπίας της αντίδρασης θέμα συντελεστής αυτός δεν είναι ακόμη ώριμες. Μοριακής δέσμης (δηλ., μοριακή σκέδαση), ιδίως η μελέτη της μοριακής διέσχισε μεθόδου δέσμης για την εφαρμογή των χημικών στοιχειώδη κινητικής αντίδρασης, έτσι ώστε στην πειραματική μελέτη σχετικά με την αντίδραση ενός ενιαίου σύγκρουσης είναι δυνατή. Μοριακή πειράματα διασταύρωσης έχουν κερδίσει πολλά από τα κλασικής χημικής κινητικής σε θέση να λάβει στοιχειώδη χημικές αντιδράσεις σε μικροσκοπική πληροφορία, Μοριακή Δυναμική αντίδραση είναι μια σύγχρονη σύνορα χημικής κινητικής. Θερμοδυναμικών ιδιοτήτων ισορροπίας δεν μπορεί να δώσει πληροφορίες για τη χημική κινητική. Για παράδειγμα, η ακόλουθη αντίδραση: 2H2 (αέριο) Ο2 (αέριο) ─ → 2H2O (αέριο) παρά Η2, Ο2 και Η2Ο σε όλες τις θερμοδυναμικές ιδιότητες είναι γνωστή με ακρίβεια, αλλά μόνο προβλέψεις δημιουργούνται H2O, Η2 και Ο2 δυνατότητα Δεν μπορούμε να προβλέψουμε H2 και O2 στις δεδομένες συνθήκες σε ποιο είδος του ποσοστού αντίδρασης για την παραγωγή H2O, δεν μπορεί να παρέχει H2 και O2 είναι μόρια που τα βήματα μέσα από το συνδυασμό των μορίων H2O πληροφοριών. Ως εκ τούτου, μια ολοκληρωμένη κατανόηση της διαδικασίας χημικής αντίδρασης και τεθεί σε εφαρμογή, δεν μπορεί να κάνει χωρίς χημική κινητική. [1] Μελέτη της ιστορίας Πρώτο μισό του 20ου αιώνα, πολλή δουλειά έρευνας είναι ο προσδιορισμός των παραμέτρων αυτών, η θεωρητική ανάλυση και η χρήση των παραμέτρων για τη μελέτη του μηχανισμού της αντίδρασης. Ωστόσο, ο μηχανισμός αντίδρασης της αναγνώρισης βασίζεται στην ανίχνευση και την ανάλυση της αντίδρασης ενδιαμέσου ικανότητα. Στα τέλη του 20ου αιώνα, ριζική κινητική αλυσιδωτή αντίδραση μελέτες γενικά πραγματοποιείται, για την ανάπτυξη της χημικής κινητικής φέρει δύο τάσεις: Πρώτον, τα στοιχειώδη κινητική της αντίδρασης μελετηθεί εκτενώς? Δεύτερο είναι επιτακτική ανάγκη να δημιουργηθεί μια μέθοδο για τον έλεγχο του ενδιάμεσου, Η απαίτηση αυτή και ηλεκτρονικών ειδών, laser ανάπτυξη της τεχνολογίας για την προώθηση της ανάπτυξης μιας ταχείας κινητικής αντίδρασης. Παροδικές δραστικά ενδιάμεσα ανιχνεύονται στο χρόνο ανάλυσης των χιλιοστών του δευτερολέπτου από το 1950 έως πικοδευτερόλεπτα. [1] Μέθοδοι Έρευνας Χημικές μέθοδοι έρευνας κινητική είναι: ① φαινομενολογική μέθοδο δυναμικής, επίσης γνωστή ως κλασική μέθοδο χημικής κινητικής, η οποία είναι από τις χημικής κινητικής των αρχικών πειραματικών δεδομένων ─ ─ συγκέντρωση c και το χρόνο t ─ ─ αναχώρησης, μετά την ανάλυση ορισμένων από τις κινητικές παραμέτρους που λαμβάνονται ─ ─ ρυθμός αντίδρασης σταθερά k, ενέργεια ενεργοποίησης Ea, προ-εκθετικό παράγοντα Α. Αυτές οι παράμετροι μπορεί να χαρακτηρίζεται από το ποσοστό των χαρακτηριστικών του συστήματος της αντίδρασης είναι συνήθως τη σχέση: όπου r είναι ο ρυθμός αντίδρασης? Α, Β, C, D είναι η συγκέντρωση κάθε ουσίας? Α, β, γ, δ σε σχέση με την γνωστή ουσία Α , Β, C, D της σειράς? R είναι η σταθερά των αερίων? Τ είναι η θερμοδυναμική θερμοκρασία. Χημική αντίδραση κινητικές παράμετροι είναι η διερεύνηση του μηχανισμού των έγκυρων στοιχείων για την ενεργό ενδιάμεσο παροδική ανάλυση του χρόνου ανίχνευσης των χιλιοστών του δευτερολέπτου από τη δεκαετία του 1950 σε ένα picosecond. ② μοριακή δυναμική ερευνητικές μεθόδους αντιδράσεως, από το μικροσκοπικό μοριακό επίπεδο, το ένα γιουάν χημική αντίδραση είναι ένα ορισμένο κβαντικές μεταξύ των αντιδρώντων μορίων συγκρούονται μεταξύ τους, Atomic αναδιάταξη, με αποτέλεσμα μια κάποια κβαντική μόρια προϊόντος κρατική χωριστά από το άλλο, καθώς ενιαία συμπεριφορά σύγκρουσης αντίδρασης. Με τη θεωρία μεταβατική κατάσταση για να εξηγήσει, είναι στο σύστημα αντίδρασης με μια πιθανή συστήματα σωματιδίων επιφανειακής ενέργειας αντιπροσώπευε μια εγκάρσια συμπεριφορά φραγμού αντιδράσεως. Κατ 'αρχήν, αν υπολογίζεται από κβαντικό σύστημα χημική αντίδραση σωστή επιφανειακό δυναμικό ενέργειας και να εφαρμόσει τους νόμους της μηχανικής σημείο αντιπροσωπευτικό υπολογισμό της τροχιάς του, μπορούμε να υπολογίσει την ταχύτητα αντίδρασης και χημική κινητική παραμέτρους. Ωστόσο, εκτός από μερικές πολύ απλή χημική αντίδραση έξω από τους υπολογισμούς κβαντοχημικά ακόμα δεν μπορεί να πάρει το σύστημα αντίδρασης, πλήρεις και αξιόπιστες επιφανειακό δυναμικό ενέργειας. Ως εκ τούτου, η τρέχουσα θεωρία ταχύτητα αντίδρασης (π.χ. σύγκρουση bimolecular θεωρία, θεωρία μεταβατικής κατάστασης), έπρεπε ακόμα να δανειστεί κλασική στατιστική προσέγγιση μηχανικής. Η επεξεργασία αυτή πρέπει να είναι κάποια μορφή παραδοχή ισοζυγίου, καθιστώντας έτσι αυτά τα θεωρητικά ποσοστά δεν μπορεί να χρησιμοποιηθεί για την πολύ γρήγορη ανταπόκριση. Παρά το γεγονός ότι η δυνατότητα εφαρμογής της ανάληψης ισορροπίας έχει πολλές, αλλά η πλήρης θεωρητική επεξεργασία των μη-ισορροπίας της αντίδρασης θέμα συντελεστής αυτός δεν είναι ακόμη ώριμες. Στη δεκαετία του 1960, για τις χημικές αντιδράσεις σε μοριακό επίπεδο των πειραματικών μελετών, είναι δύσκολο να επιτευχθεί. Είναι η εφαρμογή της σύγχρονης φυσικής χημείας, προηγμένων αναλυτικών μεθόδων σε ατομική, μοριακή επιπέδου έρευνας σε διάφορα κράτη και διαφορετικά μοριακά συστήματα πρωτόγονη μόνο μόριο δυναμική δομή μιας χημικής αντίδρασης, η διαδικασία της αντίδρασης και ο μηχανισμός αντίδρασης. Πρόκειται για ένα μικρο-επίπεδο αναχώρηση από τη μοριακή μελέτη των στοιχειωδών ταχύτητα αντίδρασης και το μηχανισμό της διαδικασίας, με επίκεντρο την εσωτερική μοριακή κίνηση και μοριακή αλληλεπίδραση που προκαλείται από τις συγκρούσεις για την παρατήρηση της δυναμικής των χημικών διεργασιών στοιχειώδη στάση απέναντι στη μάθηση. CAS Dalian Ινστιτούτο Χημικής Φυσικής, μέλος Βασικά Εργαστήριο Μοριακής Δυναμικής Αντίδρασης, η έρευνα στον τομέα αυτό έχει εξαιρετική συμβολή. ③ δίκτυο ερευνητικών μεθόδων δυναμικής, περιλαμβάνει δεκάδες ή ακόμα και εκατοντάδες στοιχειώδη αντίδραση βήματα σημαντική διαδικασία χημικής αντίδρασης (όπως η πυρόλυση υδρογονανθράκων) προσομοίωσης και βελτιστοποίησης για τον καλύτερο σχεδιασμό του αντιδραστήρα. [2] Χρήση Η χρήση της χημικής δυναμικής δύναται: (α) του φαρμάκου της μελέτης μηχανισμό υποβάθμισης? (2) τη μελέτη των παραγόντων που επηρεάζουν την αποδόμηση των φαρμάκων και τα μέτρα σταθεροποίησης? (3) προβλέπουν την εγκυρότητα των φαρμακευτικών σκευασμάτων. [2] (Α) ο ρυθμός της αντίδρασης, η σταθερά ρυθμού αντίδρασης και η αντίδραση παραγγελία 1, ο ρυθμός αντίδρασης Κοινή ταχύτητα αντιδράσεως ανά μονάδα χρόνου και ανά μονάδα όγκου του αντιδραστηρίου μείωσης συγκέντρωσης ή αύξηση της συγκέντρωσης εκφραζόμενες προϊόντος: -dC/dt, όπου C είναι η συγκέντρωση των αντιδραστηρίων στο χρόνο t, μείον η συγκέντρωση της αντίδρασης μειώνεται. [2] 2, ο ρυθμός αντίδρασης σταθερά Σύμφωνα με το νόμο της δράσης μάζας, ο ρυθμός αντίδρασης μεταξύ της συγκέντρωσης των αντιδρώντων έχει την ακόλουθη σχέση: -dC/dt = KC n (4-1) Όπου το Κ είναι η σταθερά ρυθμού της αντίδρασης είναι σε μονάδες συγκέντρωσης των αντιδραστηρίων ο ρυθμός αντίδρασης, σε μονάδες [ώρα] -1, το μέγεθος της θερμοκρασίας αντίδρασης. K τιμή δείχνει τόσο μεγαλύτερος είναι ο βαθμός των αντιδρώντων και ζωντανή, πιο ασταθής φαρμακευτικά σκευάσματα. [2] 3, η σειρά αντίδρασης Τύπου (4-1), η είναι η τάξη της αντίδρασης, η συγκέντρωση των αντιδραστηρίων Σύνολο από όλα, ότι οι αλλαγές ρυθμού αντίδρασης με τη συγκέντρωση των αντιδραστηρίων και να αλλάξει τον τρόπο. Τα περισσότερα φάρμακα μπορούν να χρησιμοποιηθούν μηδενικής τάξης διαδικασία αποικοδόμησης και ψευδείς μηδενικής τάξης της αντίδρασης, μια αντίδραση στη θεραπεία και εσφαλμένη. (Α) μηδέν-μηδέν-διαταγή αντίδρασης και ψευδείς |
| Χρήστης Ανασκόπηση | Όλα Ανασκόπηση [ 1 ]>>> |
| ||||