| Γλώσσα : |
|
| Εγκυκλοπαίδεια της κοινότητας |Εγκυκλοπαίδεια Απαντήσεις |Υποβολή ερωτήματος |Λεξιλόγιο Γνώση |Ανεβάστε τη γνώση |
Δίκαιο του Avogadro |
  |
|
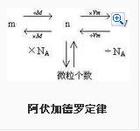
Νόμος του Avogadro (υπόθεση Avogadro) ίδια θερμοκρασία και πίεση, το ίδιο όγκο οποιουδήποτε αερίου που περιέχει τον ίδιο αριθμό των μορίων, που ονομάζεται νόμος του Avogadro. Είναι ο όγκος των μορίων του αερίου που περιέχεται στο χώρο που καταλαμβάνει, υπό κανονικές συνθήκες, η μέση απόσταση μεταξύ των μορίων του αερίου είναι περίπου 10 φορές η διάμετρος των μορίων, συνεπώς, καθορίζει τον αριθμό των μορίων που περιέχονται στο αέριο, το αέριο καθορίζεται κυρίως από τον όγκο του διαμοριακών Η μέση απόσταση από το μέγεθος του μορίου ίδια.Ορισμός Στην ίδια θερμοκρασία και πίεση, ο ίδιος όγκος οποιουδήποτε αερίου το οποίο περιέχει τον ίδιο αριθμό μορίων. Έτσι ονομάζεται τέσσερα με το νόμο, που ονομάζεται επίσης πέντε διαφορετικούς νόμους (πέντε με αναφερόμενος στην ίδια θερμοκρασία και την ίδια πίεση, την ίδια ένταση, τον ίδιο αριθμό μορίων, η ίδια ποσότητα της ουσίας). Χρησιμοποιώντας το αντικείμενο Φυσικό αέριο, μπορεί να είναι ένα ενιαίο αέριο μπορεί να είναι μικτό αέριο. Αέριο μπορεί να είναι μια ενιαία ουσία, μπορεί να είναι αέριο ενώσεως. Συμπέρασμα Νόμος (1) ίδια θερμοκρασία και πίεση, (2) Όταν ο ίδια θερμοκρασία με τον ίδιο όγκο, (3), η ίδια θερμοκρασία και πίεση, όπως η ποιότητα, η (4) Όταν η ίδια θερμοκρασία και πίεση, M1/M2 = ρ1/ρ2 Η μέση απόσταση μεταξύ των μορίων αποφάσισε επίσης την εξωτερική θερμοκρασία και την πίεση, η θερμοκρασία, η ίδια πίεση, οποιοδήποτε αέριο μόρια σχεδόν ίση με την μέση απόσταση μεταξύ του (ασθενής δράση μεταξύ των μορίων του αερίου, μπορεί να αγνοηθεί), έτσι ώστε το νόμο. Ο νόμος ορίζει ένα αέριο που συμμετέχουν στη Formula χημική αντίδραση συναγάγει το άγνωστο φυσικό αέριο, κλπ. Υπάρχει ένα ευρύ φάσμα εφαρμογών. Νόμο Avogadro ότι: στην ίδια θερμοκρασία και πίεση, το ίδιο όγκο αερίων που περιέχουν τον ίδιο αριθμό μορίων. 1811 από τον Ιταλό χημικό Avogadro υπόθεση προτεινόμενη αναγνωρίστηκε αργότερα από την επιστημονική κοινότητα. Αυτός ο νόμος αποκαλύπτει την σχέση μεταξύ του όγκου του αερίου της αντιδράσεως για να απεικονίσουν τη σύνθεση των μορίων του αερίου, η πυκνότητα αερίου προσδιορισμός του μοριακού βάρους των παρεχόμενων αέριες ουσίες. Για τη δημιουργία των ατόμων και των μορίων να πω, αλλά, επίσης, έπαιξε θετικό ρόλο. Εξίσωση Clapeyron εξίσωση, επίσης γνωστή ως η "ιδανική εξίσωση φυσικού αερίου." Υψηλή χημείας στο σχολείο, ο νόμος Avogadro καταλαμβάνει μια πολύ σημαντική θέση. Χρησιμοποιείται ευρέως, ειδικά στον Τύπο Υπολογισμός αέριες ουσίες, το μοριακό βάρος, αν χρησιμοποιηθεί σωστά, το πρόβλημα είναι εύκολο να λυθεί. Παρακάτω είναι μια σύντομη μερικές εξισώσεις που παράγονται σύμφωνα με τις σχέσεις Timberland kt με σκοπό την καλύτερη κατανόηση και χρήση του νόμου του Avogadro. Clapeyron εξίσωση εκφράζεται συνήθως με τον ακόλουθο τύπο: PV = nRT ...... ① Ρ είναι η πίεση, V είναι ο όγκος του αερίου, το η αντιπροσωπεύει το ποσό της ουσίας, το Τ είναι η απόλυτη θερμοκρασία, R είναι η σταθερά αερίου. Όλες οι τιμές αερίου R είναι τα ίδια. Αν η πίεση, η θερμοκρασία και ο όγκος χρησιμοποιούνται διεθνή μονάδα (SI), R = 8.31 Pa · m 3 / mol · ανοιχτά. Αν η πίεση είναι ατμοσφαιρική πίεση, ο όγκος είναι επάνω, τότε R = 0,082 atm · L / mol · deg. Επειδή η = m / M, ρ = m / v (n-της ουσίας, μ-η μάζα, Μ-μοριακή μάζα, η αξία ίση με τα μοριακά βάρη, ρ-πυκνότητα αέριες ουσίες), έτσι Ke Lapei Long εξίσωση μπορεί να γραφτεί σε δύο μορφές: Pv = MRT / Μ ...... ② και PM = ρRT ...... ③ Στο Α, Β δύο συζήτηση αερίου. (1) Με τον ίδιο Τ, Ρ, V Χρόνος: Σύμφωνα με ① τύπου: (νόμου, ήτοι του Avogadro) nA = ηΒ MW πρέπει να Η μοριακή αναλογία μάζας = λόγος πυκνότητας = σχετική πυκνότητα). Αν mA = mB συνέχεια MA = MB. (2) T · P την ίδια στιγμή: = Γραμμομοριακή αναλογία μάζας του όγκου του αντίστροφου? Δύο αέρια = γραμμομοριακή αναλογία της ποσότητας του αντίστροφου μάζα) Η ποσότητα της ουσίας σε αντίστροφη αναλογία = πυκνότητα αερίου? Δύο αναλογία όγκου αερίου = πυκνότητα αερίου είναι αντιστρόφως ανάλογο). (3) T · V την ίδια στιγμή: Δύο πίεση αερίου του αερίου μοριακού βάρος αναλογία = γραμμομοριακή μάζα = αντιστρόφως ανάλογο). Συμπέρασμα Δίκαιο |
| Χρήστης Ανασκόπηση | Όλα Ανασκόπηση [ 1 ]>>> |
| ||||