| Γλώσσα : |
|
| Εγκυκλοπαίδεια της κοινότητας |Εγκυκλοπαίδεια Απαντήσεις |Υποβολή ερωτήματος |Λεξιλόγιο Γνώση |Ανεβάστε τη γνώση |
Μοριακή αγωγιμότητα |
   |
|
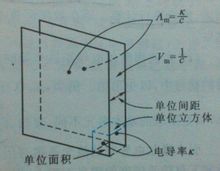
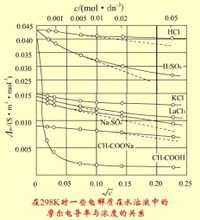
Ορισμός Γραμμομοριακή αγωγιμότητα λm (γραμμομοριακή αγωγιμότητα) αναφέρεται στο διάλυμα τοποθετήθηκε σε έναν ηλεκτρολύτη που περιέχει 1mol μονάδα απόστασης πέρα ως το κύτταρο αγωγιμότητας μεταξύ δύο παράλληλων ηλεκτροδίων, τότε έχει την αγωγιμότητα. [1]Ο τύπος Λόγω των διαφορετικών ηλεκτρολυτών ελήφθησαν 1mol, αλλά ο όγκος του διαλύματος που λαμβάνεται Vm θα αλλάξει με τη συγκέντρωση. Έστω C είναι η συγκέντρωση του διαλύματος ηλεκτρολυτών (σε mol · m-3), το διάλυμα ηλεκτρολύτη που περιέχει 1mol Vm ίσο όγκο 1 / c, σύμφωνα με τον ορισμό του κ αγωγιμότητας, k γραμμομοριακή αγωγιμότητα και ηλεκτρική αγωγιμότητα μεταξύ των λm σχέση που εκφράζεται από τον τύπο Λm = k · Vm = k / c Όπου k μονάδες της S · m-1, c μονάδες mol · m-3, έτσι ώστε οι μοριακές μονάδες λm αγωγιμότητα S · m2 · mol-1 [1] Σημασία Η έννοια της εισαγωγής μοριακή αγωγιμότητα είναι χρήσιμη. Αγωγιμότητα του ηλεκτρολύτη, επειδή η γενική περίπτωση δεν είναι όλα πάρα πολύ ισχυρή όσο η συγκέντρωση αυξάνεται και γίνεται μεγάλη, τα αγώγιμα σωματίδια αυξηθεί. Προκειμένου να διευκολυνθεί διαφορετικούς τύπους ηλεκτρολύτη αγωγιμότητας της σύγκρισης, είναι συχνά χρησιμοποιείται σε γραμμομοριακή αγωγιμότητα, επειδή τότε δεν έχει μόνο την ίδια ποσότητα ηλεκτρολύτη (ηλεκτρολύτης περιέχει 1 mol), και η απόσταση μεταξύ των ηλεκτροδίων είναι επίσης μονάδα απόστασης. Φυσικά, σε σύγκριση με την επιλεγμένη φορτίο ηλεκτρολύτη των στοιχειωδών σωματιδίων θα πρέπει να είναι το ίδιο ποσό της χρέωσης. [1] Σχέση Όταν η συγκέντρωση μειώνεται, αποδυναμώνοντας την αλληλεπίδραση μεταξύ των σωματιδίων, η θετική και αρνητική ρυθμό μετανάστευσης ιόντων της ταχύτητας, η γραμμομοριακή αγωγιμότητα του διαλύματος θα αυξηθεί. Αλλά διαφορετικές ηλεκτρολύτες, μοριακή αγωγιμότητα αυξάνεται με τη μείωση του βαθμού συγκέντρωσης είναι επίσης πολύ διαφορετική. Όταν η συγκέντρωση μειώνεται σε έναν ορισμένο βαθμό, η δύναμη της μοριακής αγωγιμότητας του ηλεκτρολύτη κοντά σε μια σταθερά τιμή, αλλά η τιμή εξακολουθεί να είναι ανεπαρκής ηλεκτρολύτη συνεχίσει να αλλάζει. [1] Αν στο ίδιο εύρος συγκέντρωσης συγκρίνουν τις διάφορες μοριακές αλλαγές αγωγιμότητα, η τιμή για παράδειγμα NaCl, H2SO4, CuSO4 σε σχέση με το άλλο, θα βρείτε, όταν η συγκέντρωση μειώνεται, κάθε μοριακή τιμές αγωγιμότητας αλλάξει σε διαφορετικούς βαθμούς. Η μεγαλύτερη αλλαγή CuSO4, H2SO4, ακολουθούμενη από την ελάχιστη αλλαγή στην NaCI. Αυτό συμβαίνει επειδή ο τύπος 2-2 σθένους άλατα έλξη μεταξύ των ιόντων είναι μεγάλη, όταν η συγκέντρωση μεταβάλλεται, ένα μεγαλύτερο αντίκτυπο στην ηλεκτροστατική έλξη, έτσι ώστε οι τιμές αγωγιμότητας γραμμομοριακή αλλάξει επίσης. Τυπικά, όταν η συγκέντρωση του ισχυρού ηλεκτρολύτη · 0,001 mol dm-3 ή μικρότερη, λm √ c και μια γραμμική σχέση μεταξύ της συγκέντρωσης c και μεταξύ των λm ακόλουθη σχέση: Όπου β σε μια ορισμένη θερμοκρασία, ο ηλεκτρολύτης και ο διαλύτης για ένα δεδομένο σκοπό είναι μια σταθερά. Λm (∞) ως διάλυμα σε άπειρη αραίωση γραμμομοριακή αγωγιμότητα, επίσης γνωστή ως περιοριστικά γραμμομοριακή αγωγιμότητα. [1] |
| Χρήστης Ανασκόπηση |
|
Δεν υπάρχουν ακόμη σχόλια |